Síndrome metabólico en el paciente renal. Revisión bibliográfica
Antonio José Martín-Hurtado1, Carmen Morales-Cuenca1, Raquel Espejo-Rodríguez1, Rodolfo Crespo-Montero1,2,3
1 Departamento de Enfermería. Facultad de Medicina y Enfermería. Universidad de Córdoba. Córdoba. España
2 Servicio de Nefrología. Hospital Universitario Reina Sofía de Córdoba. Córdoba. España
3 Instituto Maimónides de Investigación Biomédica de Córdoba. Córdoba. España
https://doi.org/10.37551/S2254-28842024029
��
Como citar este artículo:
Martín-Hurtado AJ, Morales-Cuenca C, Espejo-Rodríguez R, Crespo-Montero R. Síndrome metabólico en el paciente renal.
Revisión bibliográfica. Enferm Nefrol. 2024;27(4):294-304
Correspondencia:
|
Recepción: 29-07-2024
|
RESUMEN
Introducción: En los últimos años, la enfermedad renal crónica ha aumentado su prevalencia mundial, y las comorbilidades asociadas a su aparición, en numerosas ocasiones relacionadas con el síndrome metabólico, acentúan su desarrollo. Las enfermedades desencadenantes del síndrome metabólico han adquirido un preocupante carácter epidemiológico en la sociedad actual.
Objetivos: Revisar y sintetizar la bibliografía científica en relación el síndrome metabólico en el paciente renal crónico.
Metodología: Se ha realizado una revisión bibliográfica con búsqueda sistematizada a través de las bases de datos PubMed y Scopus. Se incluyeron artículos que referenciaran los diferentes componentes del síndrome metabólico en pacientes con patología renal, y cuya publicación estuviese comprendida entre 2019 y 2024 en inglés y español.
Resultados: Se seleccionaron 18 artículos entre los que se encuentran revisiones sistemáticas y estudios observacionales. Tras el análisis de estos, emergieron las siguientes temáticas: las alteraciones que conforman el síndrome metabólico y su influencia en la enfermedad renal crónica, la aparición del síndrome metabólico y su prevalencia, así como las medidas de prevención.
Conclusiones: Se evidencia una elevada correlación entre la existencia de enfermedades incluidas en el síndrome metabólico y el desarrollo de enfermedad renal. Entre ellos la hipertensión arterial y la diabetes mellitus destacan por encima de la obesidad y las dislipemias. La prevención y el diagnóstico precoz son considerados los mejores tratamientos.
Palabras clave: síndrome metabólico; nefropatía; tratamiento renal; obesidad; diabetes mellitus; diabético.
ABSTRACT
Metabolic syndrome in the renal patient. Literature review
Introduction: In recent years, chronic kidney disease has increased in prevalence worldwide, and the comorbidities associated with its onset, on numerous occasions related to the metabolic syndrome, accentuate its development. The diseases that trigger metabolic syndrome have acquired a worrying epidemiological character in today’s society.
Objectives: Review and synthesise the scientific literature on metabolic syndrome in chronic renal patients.
Methodology: A literature review was carried out with a systematised search using the PubMed and Scopus databases. Articles were included that referenced the different components of metabolic syndrome in patients with renal pathology and whose publication was between 2019 and 2024 in English and Spanish.
Results: 18 articles were selected, including systematic reviews and observational studies. After analysing these, the following variables emerged: the alterations that make up the metabolic syndrome and its influence on chronic kidney disease, the appearance of the metabolic syndrome and its prevalence, and prevention measures.
Conclusions: There is evidence of a high correlation between the presence of diseases in the metabolic syndrome and the development of kidney disease. Arterial hypertension and diabetes mellitus stand out above obesity and dyslipidaemia. Prevention and early diagnosis are considered the best treatments.
Keywords: metabolic syndrome; nephropathy; renal treatment; obesity; diabetes mellitus; diabetic.
INTRODUCCIÓN
En las últimas décadas la enfermedad renal crónica (ERC) ha aumentado su prevalencia mundial presentándose en un 10-13% de la población. En España, acorde a los datos del Registro Español de Enfermos Renales recopilados en 2022, se estima una incidencia de 150,0 pmp, correspondiendo a 368 pacientes de trasplante renal anticipado, 1.169 de diálisis peritoneal y 5.582 de hemodiálisis (sumando un total de 7.119 pacientes renales). Entre estos, la evolución de la Diabetes Mellitus (DM) como causa, aumentó hasta el 22,0%1. Se estima que 128 por cada 100.000 habitantes a nivel mundial murieron por esta causa2. Asimismo, las comorbilidades asociadas a su aparición, como la obesidad o la hipertensión arterial, han adquirido un preocupante carácter epidémico, convirtiendo a la ERC en un problema de salud pública.
La patogénesis relacionada con su aparición está vinculada con la presencia de glomerulonefritis crónica, pielonefritis crónica, el abuso de medicamentos antinflamatorios, las enfermedades autoinmunes, las malformaciones congénitas, enfermedades renales agudas prolongadas, trasplante de riñón y síndrome metabólico3. La literatura al respecto menciona sus síntomas más severos, asociados a los estadios avanzados, ya que, en su inicio, los pacientes son asintomáticos o padecen síntomas inespecíficos, siendo el letargo o picazón los más frecuentes4.
La definición del síndrome metabólico (SM) presenta variaciones internacionales, por lo que el estudio de su prevalencia puede verse alterado ya que está sujeto a la inclusión de diferentes parámetros, ya que es un constructo de varias causas fisiopatológicas. No obstante, en todos ellos se reconoce una particularidad unánime: un alto porcentaje de la población lo presenta. Aparece en el 35% de los adultos estadounidenses. Está caracterizado por la presencia de varias enfermedades como obesidad (OB), hipertensión (HTA), Diabetes Mellitus (DM) y dislipemias (entre las que se incluyen altos niveles de triglicéridos y bajos de HDL)5.
Cada una de las enfermedades que constituyen el SM supone un riesgo independiente para la salud, por lo que en sus diferentes combinaciones consolidan una amenaza para la salud debido a los mecanismos fisiopatológicos asociados. Estos son la resistencia a la insulina, producción de especies reactivas de oxígeno (ROS), entre las que se incluyen los radicales libres, el desarrollo de estrés oxidativo (OS) y la inflamación crónica6.
La resistencia a la insulina es la hipótesis más aceptada alrededor del SM. Al deteriorarse la acción insulínica, se produce una reducción en la síntesis de glucógeno y transporte de glucosa, a pesar de que la lipogénesis hepática no cesa. Ante la falta de glucosa dentro de la célula se estimula la tasa de lipólisis. El cúmulo de lípidos podría ser consecuencia del aumento de la entrega de ácidos grasos a los tejido5.
En los tejidos adiposos, considerados endocrinos y paracrinos, los adipocitos sufren hipertrofia e hiperplasia, induciendo a estado hipóxico. Esta situación puede favorecer la aparición de necrosis con infiltración de macrófagos y aparición de adipocinas, como la interleucina-6 (IL-6), que es una citocina inflamatoria que desempeña un papel importante en la patogénesis de la DM tipo 25.
Estudios epidemiológicos asocian el síndrome metabólico y ERC con la aparición de nefrolitiasis6-8. El vínculo que parece unirlos es el OS. Las comorbilidades mencionadas no pueden ser catalogadas como inductoras o consecuentes de esta situación, puesto que no existe consenso en el orden de aparición, determinando así la bilateralidad en su relación7.
El SM mantiene íntima relación con el desarrollo de enfermedad cardiovascular aterosclerótica debido a la presencia de inflamación crónica y/o disfunción endotelial vascular, entre otras5. Otra patología relacionada con el SM es la enfermedad hepática crónica, manifestada mediante enfermedad hepática crónica, presente en 1 de cada 4 adultos9.
Con respecto a sus factores de riesgo, incluimos los hábitos dietéticos e inactividad física (relacionados de manera más obvia con la obesidad), hábito tabáquico, factores socioeconómicos, consumo de alcohol, medicamentos como antirretrovirales o antipsicóticos. Junto a estos se encuentran algunos factores de riesgo no modificables como el historial familiar, la edad avanzada y el estado posmenopáusico, y algunas etnias (latinoamericanos). La intervención temprana, incide directamente sobre los factores de riesgo modificables5.
Por todo ello, nos planteamos realizar la presente revisión cuyo objetivo principal fue examinar y sintetizar la bibliografía científica existente del SM y su relación con la ERC.
METODOLOGÍA
Diseño del estudio
Se ha realizado una revisión bibliográfica con búsqueda sistematizada de los artículos pertenecientes a las bases de datos de ciencias de la salud, según los criterios y recomendaciones estandarizados de la declaración PRISMA (Preferred Reporting Items for Systematic Review and Meta-Analyses)10.
Estrategia de búsqueda
PubMed y Scopus han sido las bases de datos seleccionadas para la búsqueda. La conformación de los términos MeSH (Medical Subject Headings) usados en la investigación fue: “Metabolic Syndrome”, “Kidney Disease”, “Kidney Treatment”, “Obesity”, “Diabetes Mellitus”, “Diabet”. La combinación final incluyó los operadores booleanos OR y AND, utilizándose la estratgia de búsqueda: “Metabolic Syndrome” AND “Obesity” AND “Diabetes Mellitus” OR “Diabet” AND “Kidney diseases” OR “kidney treatment”.
Criterios de elegibilidad
Durante la investigación se estipularon determinados criterios aplicados al estudio.
Criterios de inclusión:
- Documentos publicados entre los años 2019 y 2024.
- Artículos originales cuya temática comprenda la ERC y el SM.
- Artículos en idiomas, tanto, en inglés, castellano o portugués.
Criterios de exclusión:
- Artículos cuyo texto completo requiera suscripción.
- Población pediátrica y adolescentes.
Análisis de calidad de los resultados
Para el análisis de la calidad metodológica de los artículos seleccionados, se emplearon las listas de verificación proporcionadas por STROBE11 para estudios observacionales y la verificación de CASPE12 para revisiones sistemáticas.
Extracción de datos
Se extrajeron las siguientes variables: autor, año, país, tipo de estudio, muestra del estudio, resultados y calidad de la evidencia.
Síntesis de resultados
Se seleccionaron 18 artículos para realizar la revisión, ajustados a los criterios establecidos. Se realizó un enfoque temático-categorial de los resultados y variables en los artículos seleccionados.
RESULTADOS
Resultados de la búsqueda
Con la conformación de búsqueda en las bases de datos seleccionadas, se procedió a la exploración de los artículos entre febrero y abril de 2024. El proceso de búsqueda se plasmó en un diagrama de flujo PRISMA (figura 1).

Inicialmente se realizó una primera búsqueda sin considerar criterios de elegibilidad, encontrándose 1.589 artículos relacionados. Aplicando los criterios previamente estipulados, se eliminaron 1.324, limitando el resultado a 265 artículos. De estos, existen cuatro situaciones de duplicidad por artículos encontrados en ambas bases de datos: uno de ellos del 2019, dos del año 2021 y uno del 2022, siendo eliminados, resultando en un total de 261. Tras la revisión del título e introducción, se eliminaron 159 artículos, quedando 102 artículos para la lectura completa. Tras la lectura, se descartaron un total de 84 de los 102. La selección final fue de 18 artículos.
Características de los resultados
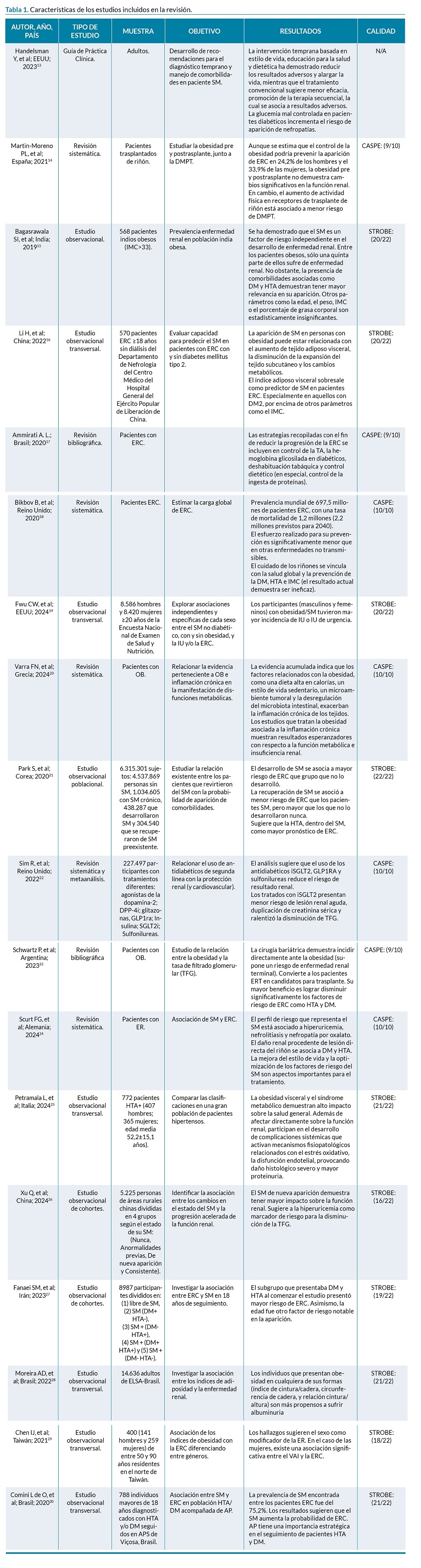
De los 18 artículos seleccionados, 10 son estudios observacionales, 5 revisiones sistemáticas, entre ellas 1 metaanálisis, 2 revisiones bibliográficas y 1 guía de práctica clínica.
En la tabla 1 se encuentran las principales características de los artículos, entre las que se incluyen: autor, país, año, tipo de estudio, muestra, objetivo, resultados y criterios de calidad.
Análisis de las variables
Prevalencia
Bagasrawala et al. detecta enfermedad renal en 1 de cada 5 pacientes sometidos a estudio (20,07%)15. Bikbov et al. en su estudio global de la población ERC, estima en cerca de 700 millones de pacientes a nivel mundial18.
Park et al., en su estudio poblacional de más de 6 millones de participantes, identifica al 16,38% de los sujetos con diagnóstico de SM, aproximadamente el 7% lo desarrolla y el 5% se recupera de esta condición. Asocia los cambios en el estado SM con alteraciones en el riesgo de ERC21.
En el estudio de Fanaei et al., la prevalencia de SM entre los sujetos fue del 36,6%. El 22,7% de los pacientes seguidos en el estudio desarrollaron ERC durante los 18 años de seguimiento. La tasa de aparición entre los participantes no SM fue de 12,1/1000/año, mientras que la de los pacientes con SM fue de 27,4/1000/año27.
Por último, Comini et al. reporta que, entre los 788 individuos diagnosticados como HTA y/o DM, el 65,4% presentaba SM. Entre los sujetos con ERC, el 75,2% presentaba SM30.
Variables sociodemográficas
La mayoría de los autores coinciden al no encontrar diferencias significativas en el sexo y la edad de los pacientes SM para el desarrollo de enfermedad renal15,16. En cambio, existen artículos que difieren en sus resultados.
Relacionado con el sexo, un estudio realizado en 2020 sugiere que en los países cuyo índice socioeconómico es menor, la prevalencia de HTA y DM es mayor, así como mayor es la dificultad de acceso a la terapia de remplazo renal. En estos países de bajo percentil socioeconómico, las mujeres tienen mayor prevalencia en los estadios 1-3 de la escala KDIGO, mientras que los hombres presentan mayor tasa de mortalidad, lo cual sugiere que el avance de la enfermedad es más rápido en ellos18.
Al igual que el anterior, el estudio realizado por Fwu et al. publicado en 2024, describe la relación entre el SM no diabético y la OB con la insuficiencia urinaria, la cual categoriza como paso previo a la ERC. Las participantes de sexo femenino sujetas a estudio presentaron una prevalencia de IU del 56%, frente al 16% presentado en hombres19.
Otro estudio, realizado por Varra et al. expone como, en los últimos 50 años, la prevalencia de SM en mujeres ha aumentado considerablemente frente al estancamiento de los hombres20.
En relación con la edad, dos de los estudios invitan a pensar que está complementando diferentes síntomas del SM, actúa como desencadenante27,30.
Alteraciones del Síndrome Metabólico
La HTA es uno de los factores determinantes, dentro de los componentes del SM para el desarrollo de la ERC25,28. Asociada a la DM, aumenta la probabilidad de aparición, siendo estas dos consideradas como las dos variables de mayor relevancia13,22,23,29. Según Fanaei et al., la presencia de ambas patologías entre la población sujeta a estudio diagnosticada con SM, se asocia en altos porcentajes a la presencia de ERC. Por el contrario, los sujetos SM carentes de estas dos alteraciones tienen una prevalencia de ERC similar a los individuos libres de SM. No obstante, este estudio transversal demuestra que la HTA es significativamente relevante27. Por el contrario, Li, H. et al. asocia la presencia de DM y la resistencia a la insulina, con una mayor probabilidad de SM entre la población ERC sujeta a estudio16.
La OB presenta controversia entre los diferentes autores. Tres de los artículos seleccionados sugieren que ante la aparición de OB (parámetros relacionados a ella como el Índice de Masa Corporal) o síntomas secundarios a ella (inflamación crónica), existe mayor riesgo para la aparición de ERC18,23,30. De acuerdo con el estudio realizado por Schwartz et al., la cirugía bariátrica, la cual incide directamente en la OB, se asocia a un progreso positivo de las alteraciones del SM como HTA, dislipemias, hiperglucemia y la potencial remisión de la situación de DM. Secundariamente dificulta la aparición de ERC y ERC terminal (ERCT)23. También existe bibliografía que relaciona la OB con la disfunción de los riñones, en concreto, la presencia de la albuminuria y proteinuria23,28.
Por el contrario, otros autores defienden en sus estudios como la aparición de OB no implica cambios significantes en la prevalencia ERC15,27,29. Fanaei et al. expone que, en pacientes de la misma edad, sexo, hábitos nocivos (tales como consumo de alcohol y tabaco) y similares componentes del SM, la circunferencia de la cintura (CC) y la reducida tasa de colesterol HDL no se asocian a la aparición de ERC27.
Acorde con el estudio anterior27, Bagasrawala S et, al. coinciden en la baja relevancia de las dislipemias, entendiendo estas como índice adiposidad visceral, porcentaje de grasa corporal y tasas de HDL y LDL, en especial en mujeres de mayor edad15. Rivalizando con esta idea, dos estudios destacan el índice de adiposidad visceral como mayor predictor del SM entre los pacientes ERC (por encima de HTA y DM)16 y entre mujeres, independientemente de su peso29.
Finalmente, cabe destacar el papel del SM como conjunto en la aparición de ERC. El estudio realizado por Comini et al. en 2020 expone entre sus resultados cómo en 75,2% de los participantes diagnosticados como ERC, presentaban SM. No obstante, no pudieron demostrar asociación entre el número de componentes de esta y la aparición30. Compartiendo esta idea, Park et al. coinciden en esta asociación (SM-ERC) y agregan nuevos datos. En estos destacan como los pacientes recuperados de SM tienen mayor riesgo de desarrollar ERC en un futuro que los sujetos que nunca sufrieron SM. Indudablemente, los pacientes con SM diagnosticado tienen mayor probabilidad27.
Tan solo uno de los artículos ofrece una perspectiva diferente sobre el orden de aparición de las enfermedades. En este caso, el estudio español realizado por Martín-Moreno P et al., nos habla sobre la DM postrasplante. Los pacientes que han sido sometidos a una operación de trasplante renal presentan riesgo de desarrollo de DM postrasplante durante su periodo de recuperación14.
El estudio realizado por Park et al. discrimina a los sujetos en función del momento de aparición del SM. Este sugiere una menor tasa de filtración glomerular en los individuos que durante el estudio han persistido en su diagnóstico de SM21. Por el contrario, el estudio realizado en 2024 por Xu Q et al., que categoriza a sus pacientes bajo los mismos criterios, suscita la idea de una menor tasa de filtración glomerular entre los pacientes SM de nueva aparición26.
Medidas de prevención
La detección, prevención y optimización de los diferentes componentes del SM es la medida más extendida para la prevención de ERC13,15-18,24-27,30. Xu Q. et al., añade la consideración del ácido úrico como factor predictor de la ERC, y no tan solo de las ya conocidas nefrolitiasis y gota26.
Otros autores proponen cambios en el estilo de vida, incidiendo en la actividad física, el control dietético y la deshabituación tabáquica u otras sustancias nocivas15,17,24,25. En particular, Ammirati et al. enfatiza la importancia de la restricción proteica entre los pacientes ERC. Además, destaca un tratamiento multidisciplinar, en el que se traten complicaciones relacionadas (tales como anemia, trastornos minerales/óseos, acidosis metabólica…). Junto a ello, propone establecer una rutina de vacunación, con especial atención a la hepatitis B17.
Tan solo tres de los autores proponen la cirugía bariátrica como tratamiento para la mejora de la función renal y tasas de filtrado glomerular. Coinciden en que es una medida a tomar ante el fracaso previo de los medios convencionales14,23,25.
Los antidiabéticos de nueva generación, tales como SGLT-2 y GLP-1, son propuestos por dos de los autores13,14. Varra et al., sugieren mejoría en la función renal y sensibilidad a la insulina con el tratamiento basado en terapia molecular20.
DISCUSIÓN
El objetivo de la presente revisión fue conocer la bibliografía con respecto a la relación de la ERC con el SM, analizando sus causas por separado y conociendo el manejo de su prevención.
Los resultados de la revisión muestran una clara asociación entre las patologías conducentes al SM y la aparición de enfermedad renal. Tan solo en uno de los artículos se comenta una potencial bilateralidad entre estos términos, al incluir la DM postrasplante como factor de riesgo tras el trasplante de riñón14.
La mayoría de las publicaciones de este estudio señalan la HTA y/o DM, como principales factores del SM para el desarrollo de la enfermedad renal13,22,23,29. En consonancia con estos resultados, un estudio transversal realizado en España en el que participaron 2.659 pacientes asocia la presencia de HTA con el riesgo de desarrollo de ERC31. Yang, H. et al. concuerda al relacionar la HTA con el desarrollo de ERC. Además, relaciona la presencia de SM con la hiperuricemia32.
A su vez, otro estudio español vincula los componentes del SM de OB, HTA, hiperglucemia y dislipidemia con el daño vascular, al cual sugiere como potencial predictor de ERC33.
Otra de las causas que se atribuyen a la incidencia son algunos tipos de dislipemia como índice adiposidad visceral y bajo colesterol HDL, o OB en cualquiera de sus métricas, como pueden ser un alto Índice de Masa Corporal, el Índice Cintura-Cadera o el Índice Cintura-Altura.
En el caso de la OB existen discrepancias. Contradiciendo la corriente anterior, entre los resultados del presente estudio encontramos diferentes autores que consideran la OB como un factor insignificante para el desarrollo de ERC15,27,29. Kang, SY et al. confirma estos resultados, al no encontrar diferencia en el riesgo de progresión de la ERC entre los pacientes obesos y no obesos sin SM, así como no atribuye mayor tasa de mortalidad por la misma34. Un estudio coreano en el que participaron 130.504 pacientes muestra que el SM tiene impacto sobre el desarrollo de la ERC. Sin embargo, rehúsa de considerar el Índice de Masa Corporal o Índice Circunferencia Cintura como factores determinantes en el desarrollo35.
Sin embargo, también existen estudios que defienden la OB como uno de los síntomas a tratar para la prevención de la ERC18,23,30. Un estudio coreano asocia la OB mediante Índice Circunferencia Cintura e Índice Circunferencia-Altura, pero no el Índice de Masa Corporal, con una disminución de la función renal36. Nuevamente Yang, H. et al. coincide al asociar la OB con menor tasa de filtrado glomerular, así como la dislipemia (aumento de triglicéridos) con ERC32.
Para la prevención de la ERC, la mayoría de los artículos revisados coinciden en considerar la prevención del SM y sus componentes como principal prevención13,15,17,18,24-27,30. De nuevo Yang, H. et al. coincide al entender esta premisa junto a la intervención temprana como medidas de gran valor32. Un estudio transversal coreano que presenta una asociación positiva entre la presencia de SM y el número de sus componentes, con el aumento de las probabilidades de aparición de cáncer de riñón, también opta por la prevención primaria de los componentes como tratamiento37.
Al igual que los artículos expuestos en los resultados15,24,25, dos estudios coinciden en considerar el ejercicio físico como factor renoprotector. El primero de ellos sostiene los efectos antioxidantes y antiinflamatorios, además del proceso de autofagia que aporta el entrenamiento39. Nataraj M et al., encontraron que la rehabilitación basada en ejercicio físico es un tratamiento eficaz para la función renal en diabéticos40.
Limitaciones del estudio
La revisión bibliográfica presenta una serie de limitaciones. La principal limitación ha sido la utilización de las bases de datos referidas en la búsqueda bibliográfica, lo que podría haber excluido artículos relevantes de otras bases de datos.
Consideraciones prácticas
Algunos de los hábitos instaurados en la sociedad actual añaden bajo interés para la conservación de la salud, siendo esta una posible explicación del carácter epidemiológico que el SM ha adquirido.
El equipo de Enfermería ejerce una importante labor en la prevención primaria de estas enfermedades. El abordaje activo, la programación de sistemas de cribado, abogar por la concienciación de la población (mediante autoexploración, por ejemplo), constituyen poderosas herramientas para lograr revertir esta situación de aumento de incidencia progresivo.
Solo repercutiendo en el estilo de vida y hábitos saludables de las personas conseguiremos prevenir la enfermedad renal.
En base a los resultados obtenidos, podemos concluir que existe una importante relación entre la evolución del SM y el desarrollo del ERC. Asimismo, los diferentes estudios no muestran claramente cuál de las alteraciones causantes de SM es más significativa, pero existe alto consenso sobre HTA y DM. En diferentes rangos, la obesidad y dislipemias muestran resultados poco concluyentes entre los diferentes autores, quedando relegadas a ser factores de riesgo poco significativos.
Entre los factores de riesgo no modificables encontramos la edad, la cual mantiene relación directa con el desarrollo del ERC, y el género, el cual muestra menor grado de influencia.
La prevención de las patologías conducentes al SM ejerce también de prevención de la ERC. Por tanto, el diagnóstico precoz junto a la prevención mediante recomendación de estilos de vida saludable, se presentan como poderosas herramientas para su tratamiento.
Conflicto de intereses
Las autoras y autores declaran no tener ningún conflicto de interés.
Financiación
Los autores declaran no haber recibido financiación alguna.
BIBLIOGRAFÍA
1. Registro Español de Enfermos Renales (REER). [consultado 21 May 2024]. Disponible en: https://www.ont.es/informacion-a-los-profesionales-4/registros-de-donacion-de-trasplantes-4-9/registro-espanol-de-enfermos-renales-4-9-4/.
2. García-Trabanino R, Hernández C, Rosa A, Domínguez Alonso J. Incidencia, mortalidad y prevalencia de enfermedad renal crónica terminal en la región del Bajo Lempa, El Salvador: 10 años de registro comunitario. Nefrologia 2016;36:517-22.
3. Martínez-Castelao A, Górriz JL, Bover J, Segura-de la Morena J, Cebollada J, Escalada J, et al. Documento de consenso para la detección y manejo de la enfermedad renal crónica. Aten Primaria 2014;46:501-19.
4. KDIGO 2024 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2024;105(4S):S117-314.
5. McCracken E, Monaghan M, Sreenivasan S. Pathophysiology of the metabolic syndrome. Clin Dermatol. 2018; 36:14-20.
6. Khan SR. Is oxidative stress, a link between nephrolithiasis and obesity, hypertension, diabetes, chronic kidney disease, metabolic syndrome? Urol Res. 2012;40: 95-112.
7. Lei X, Wen H, Xu Z. Higher oxidative balance score is associated with lower kidney stone disease in US adults: a population-based cross-sectional study. World J Urol. 2024;42(1):222.
8. Kim Y-J, Park MS, Kim W-T, Yun S-J, Kim W-J, Lee S-C. Hypertension influences recurrent stone formation in nonobese stone formers. Urology. 2011;77:1059-63.
9. Muzica CM, Sfarti C, Trifan A, Zenovia S, Cuciureanu T, Nastasa R et al. Nonalcoholic fatty liver disease and type 2 diabetes mellitus: A bidirectional relationship. Can J Gastroenterol Hepatol. 2020;2020:6638306.
10. Hutton B, Catalá-López F, Moher D. La extensión de la declaración PRISMA para revisiones sistemáticas que incorporan metaanálisis en red: PRISMA-NMA. Med Clin. (Barc) 2016;147:262-6.
11. STROBE [Internet]. [Consultado 22 May 2024]. Checklists. Disponible en: https://www.strobe-statement.org/chec-klists/.
12. Santamaría R. Programa de Habilidades en Lectura Crítica Español (CASPe). NefroPlus. 2017;9(1):100-1.
13. Handelsman Y, Butler J, Bakris GL, DeFronzo RA, Fonarow GC, Green JB et al. Early intervention and intensive management of patients with diabetes, cardiorenal, and metabolic diseases. J Diabetes Complications. 2023;37:108389.
14. Martín-Moreno PL, Shin H-S, Chandraker A. Obesity and post-transplant diabetes mellitus in kidney transplantation. J Clin Med. 2021;10:2497.
15. Bagasrawala SI, Sheth H, Shah H, Ansari R, Lakdawala M. Metabolic syndrome rather than obesity alone is more significant for kidney disease. Obes Surg. 2019;29:3478-83.
16. Li H, Wang Q, Ke J, Lin W, Luo Y, Yao J et al. Optimal obesity- and lipid-related indices for predicting metabolic syndrome in chronic kidney disease patients with and without Type 2 diabetes mellitus in China. Nutrients. 2022;14:1334.
17. Ammirati AL. Chronic kidney disease. Rev Assoc Med Bras 2020;66:S3-9.
18. Bikbov B, Purcell CA, Levey AS, Smith M, Abdoli A, Abebe M et al. Global, regional, and national burden of chronic kidney disease, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2020;395:709-33.
19. Fwu C-W, Schulman IH, Lawrence JM, Kimmel PL, Eggers P, Norton J et al. Association of obesity, metabolic syndrome, and diabetes with urinary incontinence and chronic kidney disease: Analysis of the national health and nutrition examination survey, 2003-2020. J Urol. 2024;211:124-33.
20. Varra F-N, Varras M, Varra V-K, Theodosis-Nobelos P. Molecular and pathophysiological relationship between obesity and chronic inflammation in the manifestation of metabolic dysfunctions and their inflammation-mediating treatment options (Review). Mol Med Rep. 2024;29(6):95.
21. Park S, Lee S, Kim Y, Lee Y, Kang MW, Han K et al. Reduced risk for chronic kidney disease after recovery from metabolic syndrome: A nationwide population-based study. Kidney Res Clin Pract. 2020;39:180-91.
22. Sim R, Chong CW, Loganadan NK, Fong AYY, Navaravong L, Hussein Z et al. Comparative effectiveness of cardiovascular, renal and safety outcomes of second-line antidiabetic drugs use in people with type 2 diabetes: A systematic review and network meta-analysis of randomised controlled trials. Diabet Med. 2022;39(3):e14780.
23. Schwartz P, Capotondo MM, Quaintenne M, Musso-Enz GM, Aroca-Martinez G, Musso CG. Obesity and glomerular filtration rate. Int Urol Nephrol. 2023;56:1663-8.
24. Scurt FG, Ganz MJ, Herzog C, Bose K, Mertens PR, Chatzikyrkou C. Association of metabolic syndrome and chronic kidney disease. Obes Rev. 2024;25(1):1-16.
25. Petramala L, Gigante A, Sarlo F, Servello A, Circosta F, Marino L et al. Relevance of obesity-related organ damage and metabolic syndrome classification in cardiovascular and renal risk stratification in patients with essential hypertension. Front Cardiovasc Med. 2024;28;11:1369090.
26. Xu Q, Fan X, Chen G, Ma J, Ye W, Ai S et al. New-onset metabolic syndrome is associated with accelerated renal function decline partially through elevated uric acid: an epidemiological cohort study. Front Endocrinol (Lausanne). 2024;15:1328404.
27. Fanaei SM, Mehran L, Amouzegar A, Masoumi S, Amouzegar A, Azizi F. The impact of metabolic syndrome on chronic kidney disease development. Insights from a big prospective study. Eur J Clin Invest. 2023;53(4):e13945.
28. Moreira AD, Velasquez-Melendez G, Ladeira RM, da Silva Junior GB, Fonseca M de J, Barreto SM. Association between adiposity indexes and kidney disease: Findings from the longitudinal study of adult health (Elsa-Brazil). J Am Nutr Assoc. 2022;41:275-80.
29. Chen I-J, Hsu L-T, Lu M-C, Chen Y-J, Tsou M-T, Chen J-Y. Gender differences in the association between obesity indices and chronic kidney disease among middle-aged and elderly Taiwanese population: A community-based cross-sectional study. Front Endocrinol (Lausanne). 2021; 12.
30. Comini L de O, de Oliveira LC, Borges LD, Dias HH, Batistelli CRS, da Silva LS et al. Individual and combined components of metabolic syndrome with chronic kidney disease in individuals with hypertension and/or diabetes mellitus accompanied by primary health care. Diabetes Metab Syndr Obes. 2020;13:71-80.
31. Crespo JJ, Piñeiro L, Otero A, Castiñeira C, Ríos MT, Regueiro A et al. Administration-time-dependent effects of hypertension treatment on ambulatory blood pressure in patients with chronic kidney disease. Chronobiol Int. 2013;30:159-75.
32. Yang H, Cui Z, Quan Z. Effects of metabolic syndrome and its components on chronic kidney disease and renal function: A two-sample Mendelian randomization study. Metab Syndr Relat Disord. 2024;22:114-22.
33. Rodríguez-Rodríguez R, Hornum M, Rodríguez Rodríguez AE, Bevc S, Trevisani F, Fernández G et al. Renal disease in metabolic syndrome: The hidden role of intrarenal ischemia. Kidney Int Rep. 2024;9:1419-28.
34. Kang SY, Lee YH, Jeong SJ, Kim JS, Jeong KH, Hwang HS. How obesity and metabolic syndrome affect cardiovascular events, progression to kidney failure and all-cause mortality in chronic kidney disease. Nephrol Dial Transplant. 2024;39:778-87.
35. Yang J, Lee HS, Lim CY, et al. Impact of obesity on renal function in elderly Korean adults: a national population-based cohort study. Kidney Research and Clinical Practice. 2024;j.krcp23.187.
36. Oh H, Quan SA, Jeong J-Y, Jang S-N, Lee JE, Kim D-H. Waist circumference, not body mass index, is associated with renal function decline in Korean population: Hallym aging study. PLoS One. 2013;8:e59071.
37. Wang L, Du H, Sheng C, Dai H, Chen K. Association between metabolic syndrome and kidney cancer risk: a prospective cohort study. Lipids Health Dis. 2024;17;23(1)142.
38. Perreault L, Pan Q, Aroda VR, Barrett-Connor E, Dabelea D, Dagogo-Jack S et al. Exploring residual risk for diabetes and microvascular disease in the Diabetes Prevention Program Outcomes Study (DPPOS). Diabet Med. 2017;34:1747-55.
39. Malheiro LFL, Fernandes MM, Oliveira CA, Barcelos I de S, Fernandes AJV, Silva BS et al. Renoprotective mechanisms of exercise training against acute and chronic renal diseases – A perspective based on experimental studies. Life Sci. 2024;346:122628.
40. Nataraj M, Maiya GA, Nagaraju SP, Shastry BA, Shivashankara KN, Shetty S et al. Effect of exercise-based rehabilitation on functional capacity and renal function in type 2 diabetes mellitus with nephropathy: a randomized controlled trial. Int Urol Nephrol. 2024;56(8):2671-82.
Este artículo se distribuye bajo una Licencia Creative Commons Atribución–NoComercial 4.0 Internacional.
https://creativecommons.org/licenses/by-nc/4.0/
