Clasificación funcional del paciente anciano en hemodiálisis y su influencia en la individualización del tratamiento
Mª Luz Sánchez-Tocino1, Blanca Miranda-Serrano2, Silvia Villoria-González1, Mónica Pereira-García2, Antonio López-González3, Emilio González-Parra4
1 Fundación Renal Íñigo Álvarez de Toledo. Salamanca. España
2 Fundación Renal Íñigo Álvarez de Toledo. Madrid. España
3 Complejo Hospitalario Universitario A Coruña. España
4 Servicio de Nefrología e Hipertensión. Fundación Jiménez Díaz. Madrid, España
https://doi.org/10.37551/S2254-28842022003
Como citar este artículo:
Sánchez-Tocino ML, Miranda-Serrano B, Villoria-González S, Pereira-García M, López-González A, González-Parra E.
Clasificación funcional del paciente anciano en hemodiálisis y su influencia en la individualización del tratamiento. Enferm
Nefrol. 2022;25(1):29-38
Correspondencia:
|
Recepción: 20-11-2021
|
RESUMEN
Introducción: La edad de los pacientes en hemodiálisis está aumentando, presentando mayor deterioro.
Objetivos: Conocer la situación del paciente ancia-no en hemodiálisis categorizando nuestra población. Ana-lizar la relación entre las escalas de funcio-nalidad, desnutrición y comorbilidad.
Material y Método: Estudio descriptivo transversal, pacien-tes 75-95 años. Se midieron: a) Comorbilidad-CHARLSON: alta (>6 puntos). b) Nutrición-MISS: extremadamente des-nutrido (<10 puntos.); desnutrición muy severa (>7-10 puntos); moderada-severa (>5-7 puntos); leve-moderada (>2-5 puntos); normonutrido (<2 puntos); c) Dependencia-BAR-THEL, independiente (100 puntos); dependencia leve (91-99 puntos); moderada (61-90 puntos.); severa (21-60 puntos.); total (<20 puntos). d) Fragilidad-FRAIL, no fragilidad (0 puntos); prefrágil (1-2 puntos); frágil (>3 puntos).
Resultados: 60 pacientes, 68% (41) hom-bres, edad media 81,85±5,58 años y tiempo HD 49,88±40,29 meses. Etiología más prevalente, diabe-tes mellitus (28%). MIS: 6,01±3,80 puntos. clasificándose 8 (13%) normonu-tridos, 24 (40%) desnutrición leve-moderada, 10 (17%) desnutrición moderada-severa, 13 (22%) desnutrición muy severa y 5 (8%) extremadamente desnutridos. BARTHEL: 88,16±18,59 puntos, clasificó 32 (53%) independientes, 6 (10%) dependencia leve, 17 (28%) dependencia modera-da, 4 (7%) dependencia severa, 1 (2%) dependencia total. FRAIL: 1,98±1,32 puntos, clasificó 10 (17%) no frágiles, 31 (51%) prefrágiles y 19 (32%) frágiles. CHARLSON: 10,01±2,20 puntos. Presentando 60 (100%) alta comorbilidad. CHARLSON presentó diferencias entre sexo, mayor en hombres (p=0,002). Se encontró alta correlación entre Barthel y Frail (r=0,647, p<0,001), moderada entre MIS y Barthel (r=0,556, p<0,001) y MIS y Frail (r=0,455, p<0,001). Charlson obtuvo peor correlación.
Conclusiones: Se evidenció gran deterioro ge-neral del paciente añoso en diálisis, alertando sobre la nece-sidad de realizar tratamientos individualizados enfocados en su recuperación, incluida la propia diálisis.
Palabras Clave: hemodiálisis; anciano; desnutrición; dependencia; fragilidad; comorbilidad.
ABSTRACT
Functional classification of the elderly haemodialysis patient and its influence on individualisation of treatment
Introduction: The age of patients on hemodialysis is increasing, presenting greater deterioration.
Objectives: To know the situation of the elderly patient on hemodialysis, categorizing our population. Analyze the relationship between the scales of functionality, malnutrition and comorbidity.
Method: Cross-sectional descriptive study, patients 75-95 years old. Were measured: a) Comorbidity-CHARLSON: high (>6 points). b) Nutrition-MISS: extremely malnourished (<10 points); very severe malnutrition (>7-10 points); moderate-severe (>5-7 points); mild-moderate (>2-5 points); normonourished (<2 points); c) Dependence-BARTHEL, independent (100 points); dependency level (91-99 points); moderate (61-90 points); severe (21-60 points); totals (<20 points). d) Frailty-FRAIL, without frailty (0 points); prefragile (1-2 points); fragile (>3 points).
Results: 60 patients, 68% (41) men, mean age 81.85±5.58 years and HD time 49.88±40.29 months. Most prevalent etiology, diabetes mellitus (28%). MIS: 6.01±3.80 points. classifying 8 (13%) as normonourished, 24 (40%) as mild-moderate malnutrition, 10 (17%) as moderate-severe malnutrition, 13 (22%) as very severe malnutrition, and 5 (8%) as extremely malnourished. BARTHEL: 88.16±18.59 points, classified 32 (53%) independent, 6 (10%) mild dependence, 17 (28%) moderate dependence, 4 (7%) severe dependence, 1 (2%) dependence total. FRAGILE: 1.98±1.32pts, classified 10 (17%) non-frail, 31 (51%) pre-frail and 19 (32%) frail. CHARLSON: 10.01±2.20 points. Presenting 60 (100%) high comorbidity. CHARLSON presented differences between sex, higher in men (p=0.002). High coincidence was found between Barthel and Frail (r=0.647, p<0.001), moderate between MIS and Barthel (r=0.556, p<0.001) and MIS and Frail (r=0.455, p<0.001). Charlson was the scale with the worst correlation.
Conclusions: The results showed a great general deteriora-tion of elderly patients on dialysis, highlighting the need for individualised treatments focused on their recovery, inclu-ding the dialysis technique itself.
Key Words: haemodialysis; elderly; malnutrition; dependency; frailty; comorbidity.
INTRODUCCIÓN
Con el incremento de la esperanza de vida y el crecimiento de los trastornos asociados al estilo de vida la prevalencia de la enfermedad renal crónica (ERC) va en aumento1. Este envejecimiento en la población general, se ve reflejado en las unidades de hemodiálisis (HD). El continuo desarrollo de las técnicas dialíticas, junto con la corrección de la anemia, manejo del hiperparatiroidismo secundario, así como la implementación de programas de prevención en nuestros sistemas de salud, han influido en la mejora de la supervivencia2,3.
El estado funcional de un individuo refleja su capacidad para realizar las actividades para satisfacer las necesidades básicas de la vida diaria, continuar con su rol de vida y mantener la salud y el bienestar. Por lo tanto, un buen estado funcional es un factor clave para la calidad de vida. La edad avanzada y la presencia de enfermedades crónicas son factores que afectan la capacidad funcional de cualquier individuo. Un estado funcional deficitario a menudo se asocia con una supervivencia inferior en personas mayores y pacientes que padecen enfermedades crónicas. Al igual que con otras enfermedades crónicas, un estado funcional bajo se correlaciona con la morbilidad-mortalidad de pacientes ancianos con ERC4,5,6.
Resulta complicado establecer la manera de medir la funcionalidad del paciente anciano en HD, dado que existen multitud de escalas que determinan la falta de función o actividad7. A su vez, la presencia de patologías asociadas, van a condicionar la aparición o la gravedad de la disfunción. Igualmente, una nutrición deficitaria influirá en la capacidad funcional de los pacientes. En el envejecimiento se producen una serie de cambios físicos, alteración de la dentición, pérdida de gusto y olfato, alteración en digestión y absorción de micronutrientes que, acompañados de los cambios sociales, soledad o institucionalización y psicológicos, deterioro cognitivo y/o depresión hacen que la desnutrición sea uno de los grandes síntomas geriátricos8.
En el paciente renal anciano, la malnutrición puede producirse tanto por una dieta inadecuada, como por otros factores no relacionados con la ingesta. Las comorbilidades del paciente renal, la aparición de procesos catabólicos intercurrentes, la acidosis metabólica, alteraciones endocrinas y la propia técnica de diálisis puede contribuir tanto por un efecto inflamatorio y catabólico directo como por la pérdida de nutrientes por el dializado9.
Son muchos los estudios que relacionan la dependencia, la fragilidad, comorbilidad y desnutrición con disfunción10,11.
El objetivo de nuestro estudio fue conocer la situación de la funcionalidad en los pacientes muy ancianos en HD, determinando la prevalencia de dependencia, fragilidad, comorbilidad y desnutrición, para categorizar nuestra población y poder adaptar e individualizar su tratamiento. Secundariamente se analizó la relación entre las distintas escalas de medida aplicadas a nuestra población.
MATERIAL Y MÉTODO
Se realizó un estudio descriptivo observacional de corte transversal, realizado en febrero de 2019 a 60 pacientes, de edades comprendidas entre los 75 y 95 años, con más de tres meses en programa de HD. Los sujetos recibían tratamiento en dos unidades extrahospitalarias y una unidad hospitalaria de la Fundación Renal Íñigo Álvarez de Toledo, de las provincias de Salamanca y Madrid. Todos los participantes firmaron consentimiento informado para su participación.
Variables principales
Se estudiaron:
- Comorbilidad, determinada por el Índice de CHARLSON.
El índice de comorbilidad de Charlson, fue descrito en 1986 y es un método simple y de fácil aplicación para clasificar la comorbilidad a través de un índice ponderado que tiene en cuenta el número y la gravedad de la enfermedad comórbida y permite evaluar el riesgo de muerte por enfermedad. Además de la edad, añade 1 punto por cada década de vida a partir de los 40 años, consta de 19 ítems (con puntuaciones del 1 al 6), si están presentes, se ha comprobado que influyen de una forma concreta en la esperanza de vida del sujeto. Inicialmente adaptado para evaluar la supervivencia al año, se adaptó finalmente en su forma definitiva para supervivencia a los 10 años12.
La utilidad del índice de comorbilidad de Charlson en personas mayores se ha cuestionado porque subestima las enfermedades prevalentes en este grupo de edad; solo asigna 1 punto a la demencia y no considera el parkinsonismo, anemia, discapacidad visual y auditiva o depresión como elementos, siendo estos frecuentes en las personas ancianas. Tampoco refleja la gravedad de la enfermedad, exceptuando la gradación que ofrece en enfermedad hepática, insuficiencia renal y diabetes, ni diferencia entre los tipos de tumor. Asimismo, considera el sida como la enfermedad más grave, sin tener en cuenta que ha cambiado el pronóstico pasando de ser patología mortal a crónica y que su prevalencia en personas mayores es baja.
Se han establecido varios puntos de corte, por encima de los 3 puntos ya se considera alta comorbilidad13. En pacientes en diálisis se ha considerado comorbilidad alta por encima de los 6 puntos14. Estableciéndose un aumento significativo de la mortalidad en un año en aquellos pacientes con Charlson por encima de 8 puntos14,15.
- Marcador desnutrición-inflamación, mediante escala MIS.
MIS es una puntuación totalmente cuantitativa adoptada de una evaluación global subjetiva. La escala está desarrollada para la identificación precoz de estados de desnutrición-inflamación. Existen estudios que han establecido una relación entre el MIS y parámetros nutricionales, estado inflamatorio y mortalidad16.
Se trata de un cuestionario validado para la población en diálisis que está compuesto por 10 componentes, cada uno de ellos con una valoración de 0 a 3: cambio de peso, apetito, síntomas gastrointestinales, capacidad funcional relacionada con factores nutricionales, comorbilidades incluyendo años en diálisis, pérdida de grasa subcutánea, masa muscular, índice de masa corporal, albúmina sérica, capacidad total de fijación del hierro. La puntuación va de 0 a 30 puntos. Por encima de 10 puntos podemos considerar al paciente extremadamente desnutrido, de 7 a 10 puntos desnutrición muy severa, de 5 a 7 puntos desnutrición moderada-severa, de 2 a 5 puntos desnutrición leve-moderada y menos de 2 puntos estaría normonutrido16.
- Escala de evaluación de dependencia, BARTHEL.
Para valorar el grado de dependencia funcional, el índice de Barthel es considerado como la escala más adecuada para valorar las actividades básicas de la vida diaria (ABVD), obteniéndose una estimación cuantitativa del grado de dependencia de la persona evaluada. A medida que aumenta la edad, también se incrementa el riesgo de perder la autonomía y de independencia para realizar estas actividades cotidianas. La capacidad funcional es un parámetro de salud, por lo que su mantenimiento y su mejora es tan importante como el tratamiento de una enfermedad. La pérdida de capacidad funcional se asocia con una mayor probabilidad de institucionalización, utilización de servicios sanitarios y de mortalidad17.
Entre las principales causas que alteran la capacidad funcional de los ancianos se encuentran las enfermedades crónicas, las patologías mentales, la desnutrición, e incluso el propio ingreso de una persona válida en una institución17.
Las ABVD hacen referencia a los niveles de función más elementales, actividades como comer, desplazarse, vestirse o ir al aseo. En el índice de Barthel, los valores que se le asignan a cada actividad dependen del tiempo empleado en su realización y de la necesidad de ayuda para llevarlo a cabo. El rango global varía entre 0 y 100 puntos. Por debajo de los 20 puntos tenemos la dependencia total, de 21 a 60 puntos dependencia severa, de 61 a 90 puntos dependencia moderada, de 91 a 99 dependencia leve y 100 puntos determinaría la independencia. Este test no solo aporta una valoración global de la funcionalidad sino que además muestra las deficiencias específicas de cada una de las actividades, facilitando la valoración de la evolución del paciente18.
- Escala de evaluación de fragilidad, FRAIL
La escala FRAIL es una escala de valoración de fragilidad, definida como un estado de vulnerabilidad que conlleva a un mayor riesgo de desenlaces adversos ante situaciones de estrés. Consta de 5 componentes: (1) fatiga (sentirse cansado todo el tiempo o la mayor parte del tiempo); (2) resistencia (dificultad para subir 10 escalones sin descanso y sin ayuda); (3) deambulación (dificultad para caminar varios cientos de metros sin ayuda); (4) enfermedad (más de 4 de las siguientes enfermedades: hipertensión, diabetes, cáncer que no sea cáncer de piel menor, enfermedad pulmonar crónica, ataque cardíaco, insuficiencia cardíaca congestiva, angina de pecho, asma, artritis, accidente cerebrovascular y enfermedad renal); y (5) pérdida de peso (más del 5% de pérdida de peso). La escala FRAIL otorga un rango de puntuación de 0 a 5, un punto para cada componente, y clasifica a las personas como no frágiles, prefrágiles y frágiles si obtienen una puntuación de 0, 1 a 2, 3 o superior, respectivamente19.
Variables secundarias
Se determinaron como variables antropométricas: altura, peso e índice de masa corporal (IMC), perímetro braquial, de cintura y cadera determinando el índice cintura-cadera (ICC). Además de los pliegues tricipital, abdominal y subescapular.
Analíticamente se determinó: albúmina, proteínas, hemoglobina, hematocrito, tasa de catabolismo proteico (PCR) y 25OH Vitamina D. Además, se estableció la medida de eficacia dialítica mediante Kt/V de Daugirdas.
Mediante bioimpedancia se determinó: masa muscular y ángulo de fase, masa grasa, masa libre de grasa, masa extracelular y masa celular total. Agua corporal, extracelular, intracelular, sobrehidratación e hidratación de la masa libre de grasa.
Por último, se registraron como variables demográficas edad, sexo y variables de la enfermedad renal, etiología de la misma y tiempo en hemodiálisis.
Análisis estadístico
El abordaje estadístico se llevó a cabo con el programa IBM SPSS Statistics V20. Las variables cuantitativas se presentaron como media y desviación estándar. Las variables cualitativas, mediante cifras absolutas y porcentajes.
Se utilizó la t-student para análisis comparativo entre variables cuantitativas y el coeficiente de Pearson para el estudio correlacional, previo contraste del criterio de normalidad a través de la prueba Kolmogorov-Smirnov. Se evaluó la asociación entre variables cualitativas a través del test ji cuadrado. Se concretó el nivel de significación estadística para una p menor o igual a 0,05.
Aspectos éticos
Este estudio fue aprobado por comité de ética del Hospital Universitario Fundación Jiménez Díaz (acta número 03/19), cumpliéndose los estándares reconocidos por la Declaración de Helsinki de la Asociación Médica Mundial, así como las Normas de Buena Práctica Clínica, además del cumpliendo de la legislación española sobre investigación biomédica (Ley 14/2007). Todos los participantes firmaron consentimiento informado para su participación.
RESULTADOS
Participaron en el estudio 60 pacientes. El 68% (n=41) fueron hombres, con edad media 81,85±5,58 años y tiempo de estancia en HD 49,88±40,29 meses. En cuanto a las etiologías de la enfermedad renal fueron: diabetes mellitus (28%), enfermedad renal no filiada (32%), nefroangioesclerosis (20%), nefritis intersticial (7%), glomerulonefritis (5%) y otros (8%).
En la tabla 1 se analizan datos demográficos, datos antropométricos, analíticos y de composición corporal de la muestra estudiada. Se describe el análisis por sexo intentando ver las diferencias entre ambos. Se observan diferencias entre sexos en cuanto a la antropometría, composición corporal y Kt/V que se explican por la diferente distribución corporal entre sexos20,21.
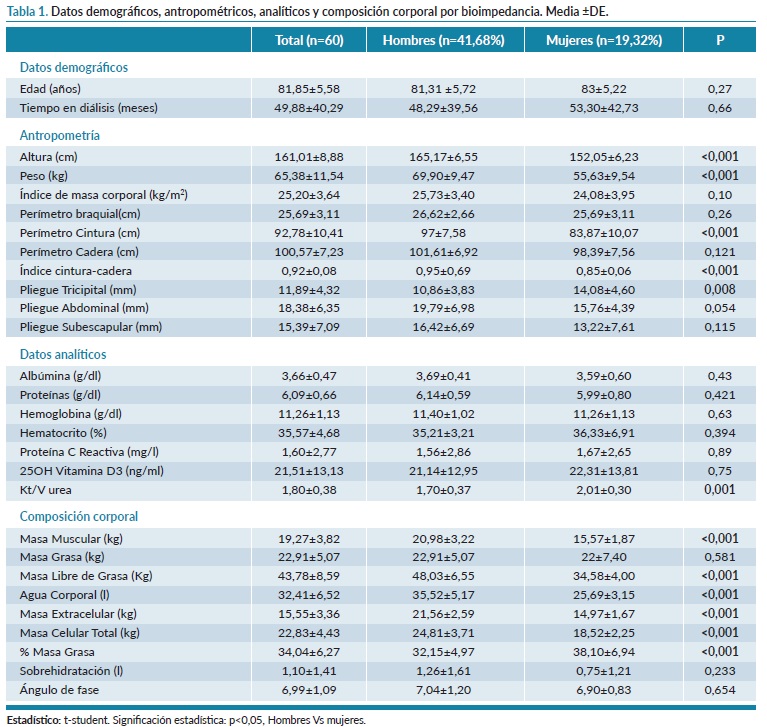
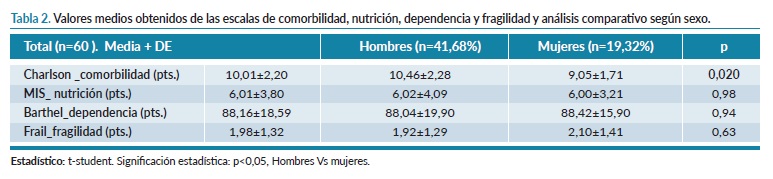
A continuación, evaluamos las escalas de funcionalidad, comorbilidad y desnutrición de la muestra, como se muestra en la tabla 2. La puntuación de Charlson fue mayor en los hombres que en las mujeres (10,46±2,28 vs 9,05±1,7, p=0,020), pero no existen diferencias en la escala marcadora de nutrición, dependencia y fragilidad.
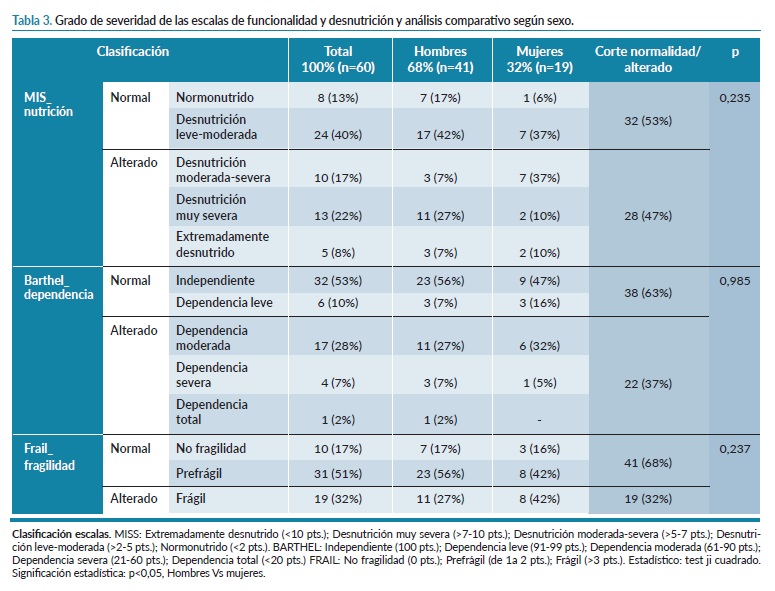
En la tabla 3 se analiza la situación de la muestra teniendo en cuenta los puntos de corte establecidos por las distintas escalas para la categorización de la población. No se han analizado los datos cualitativos de la escala Charlson, ya que los 60 pacientes (100%) estarían en la clasificación de alta comorbilidad (>6 puntos). Como se aprecia 28 (47%) de los pacientes presentan desnutrición clasificada entre moderada y extremadamente desnutrido, 38 (63%) son dependientes y 19 (32%) son pacientes frágiles. Respecto a la variable sexo, no encontramos diferencias entre sexos en los cortes cualitativos normalidad/alterado de las tres variables.
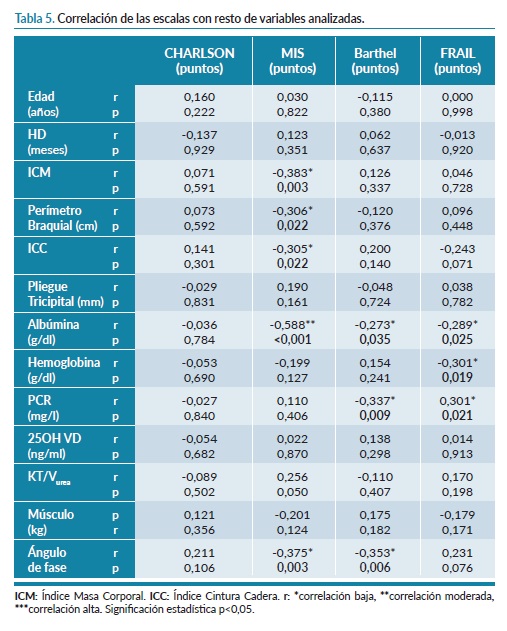
El análisis de la correlación existente entre las distintas escalas usadas para la categorización de nuestra población se presenta en la tabla 4. Como se ve la peor correlación viene dada por la escala Charlson, que no correlaciona con nutrición y lo hace de manera débil con dependencia y fragilidad. Por otro lado, la escala MIS correlacionó moderadamente con Barthel y Frail y estas presentaron una alta correlación entre ellas.

Por último, la tabla 5 representa la correlación entre las distintas escalas analizadas y el resto de variables. Como vemos la escala Charlson es la que peor correlaciona y la escala MIS es la que correlaciona con mayor número de variables. Respecto a las variables secundarias, la albúmina correlacionó con todas las escalas salvo con la escala de Charlson.
DISCUSIÓN
Este estudio describe la situación funcional del paciente muy anciano en HD a través de las escalas que miden comorbilidad, desnutrición, dependencia y fragilidad. Encontramos que los 60 pacientes estudiados (100%), presentaban una alta comorbilidad, el 47% de los pacientes presentan desnutrición entre severa y extrema, (8% extrema), el 37% presenta dependencia de moderada a total y el 32% son pacientes frágiles. Estos resultados nos evidencian el gran deterioro funcional general del paciente añoso en diálisis; la funcionalidad es un factor clave para la calidad de vida, pero a menudo se pasa por alto. La enfermedad renal impone restricciones importantes a la salud física y mental, de manera que las actividades diarias pueden verse comprometidas. El inicio de la diálisis en sí mismo puede conducir a una reducción constante y sostenida de la actividad funcional en adultos mayores con enfermedad renal22. El estudio DOPPS, mostró que las discapacidades asociadas con la enfermedad renal o la diálisis pueden tener un efecto multiplicador en las personas mayores10, así las consecuencias de la diálisis no pueden extrapolarse a pacientes comparativamente más jóvenes, ya que en los ancianos la disfunción asociada a las misma es mucho mayor. En este sentido, los tratamientos dialíticos tienen que adaptarse a la situación de paciente mayor, valorando tanto su estado nutricional, como su capacidad para realizar las actividades de la vida diaria, comorbilidad y fragilidad.
Nuestros resultados presentan un importante deterioro nutricional del paciente anciano en HD, observando que casi un 50% de los pacientes tenían desnutrición de moderada a extrema. Sin embargo, en otro grupo de población mayor de 75 años sin enfermedad renal y con autonomía funcional, el 74% presentó un buen estado nutricional13. Esta diferencia de porcentaje entre la población general y los pacientes en hemodiálisis muestra la importante repercusión de la propia diálisis en los parámetros nutricionales del enfermo renal. Además de la disminución de la ingesta, hay una pérdida de aminoácidos, péptidos y proteínas a través de la membrana de diálisis lo que disminuye la disponibilidad de sustrato para la síntesis de las proteínas musculares9,23. La propia diálisis produce un estímulo inflamatorio con activación de citoquinas, lo que aumenta la degradación muscular y el desgaste proteico energético, especialmente si se utiliza un líquido de diálisis de baja calidad microbiológica, filtros bioincompatibles o se reutilizan los filtros24. En este sentido tendremos que individualizar la diálisis en los pacientes que presentan desnutrición y aparte de la suplementación en la alimentación deberemos revisar que las técnicas y las membranas que se utilicen produzcan la menor pérdida de nutrientes posible.
Se ha demostrado que los sujetos con riesgo de desnutrición o con desnutrición establecida tienen un deterioro de las ABVD y fragilidad, lo que da lugar a una mayor dependencia funcional25,26. En nuestro estudio encontramos correlación entre las escalas que miden nutrición, dependencia y fragilidad, incluso la albúmina siendo un parámetro analítico clásicamente usado como marcador nutricional correlacionó con las tres escalas. Así la hipoalbuminemia estará presente en este perfil de pacientes con deterioro funcional. El estudio de Lowrie y Lew27, mostró que la hipoalbuminemia severa (<2,5g/dl) aumentaba 20 veces el riesgo de mortalidad comparada con normoalbuminemia (3,5-4g/dl) en pacientes en HD.
Existe una amplia variabilidad en la prevalencia de fragilidad para la población en diálisis, encontrando variaciones entre el 26% y el 73%28. Esta se puede explicar por las diferencias en las poblaciones estudiadas y las distintas herramientas empleadas en la valoración de la fragilidad28. En nuestro estudio encontramos un 32% de pacientes frágiles, además un 51% fueron etiquetados como prefrágiles. Estos resultados están en sintonía con otros estudios recientes en pacientes en HD donde se presentaron cifras de fragilidad del 34% y prefragilidad del 46%29. La fragilidad tiene una relación directa con la dependencia, ambos aspectos van a condicionar la capacidad del individuo para realizar las ABVD y así se muestra en nuestro estudio, donde encontramos una correlación alta entre ambas escalas, ya descrita anteriormente por otros autores30. El 37% de los pacientes estudiados presentó una dependencia de moderada a total (menos de 60 puntos), cifras semejantes se han descrito en poblaciones que aun no siendo enfermos renales presentaban múltiples patologías31.
Este perfil de paciente frágil y dependiente necesita un tratamiento que no limite aún más sus niveles de actividad. Se ha demostrado que la fatiga posterior a la diálisis y los rápidos cambios de volumen pueden tener un impacto en el estado general y la funcionalidad tras los tratamientos22. De manera que hay que valorar si en estos pacientes nos prima más evitar el agotamiento postdiálisis aplicando diálisis más cortas a pesar de disminuir la eficacia de las mismas.
Estudiamos también la comorbilidad de nuestros pacientes a través de índice de Charlson. El 100% de los pacientes presentaron una alta comorbilidad, más de 6 puntos, considerado este el corte que marca una alta comorbilidad en los pacientes en HD14,15.
Estos resultados eran de esperar dado la edad de nuestra muestra y la alta comorbilidad que se asocia a los pacientes en HD33. A pesar de esto, la comorbilidad ha sido la única escala que no ha presentado correlación con el resto de escalas evaluadas ni con el resto de variables analizadas. Otros autores han señalado que la dependencia, la desnutrición, la discapacidad, las malas condiciones sociales y económicas, tienen un efecto significativo en la calidad de vida, mientras que el papel de las comorbilidades parece ser menos importante34. Incluso se ha propuesto el uso del test de Barthel como un instrumento más útil para la predicción de mortalidad e institucionalización frente al índice de Charlson35. En estudios recientes en HD, la fragilidad tampoco se correlaciona con el índice de Charlson. Quizás la patología valorada por este test puede no ser sensible a la hora de estudiar esta situación clínica30.
A la vista de los resultados encontrados, se evidencia el gran deterioro general funcional del paciente añoso en diálisis y nos alerta sobre la necesidad de realizar tratamientos individualizados enfocados en su recuperación, incluida la propia diálisis.
Todas las escalas analizadas son fáciles de aplicar aportando información sobre el estado de nuestros pacientes. Existe una buena correlacionaron entre ellas salvo comorbilidad que no correlacionó con desnutrición y lo hizo de manera débil con dependencia y fragilidad.
En cuanto al resto de variables analizadas la escala desnutrición-inflamación MIS se correlacionó con mayor número de variables y la variable albúmina relacionó significativamente con todas las escalas salvo con comorbilidad.
BIBLIOGRAFÍA
1. Hill NR, Fatoba ST, Oke JL, Hirst JA, O’Callaghan CA, Lasserson DS, et al. Global Prevalence of Chronic Kidney Disease - A Systematic Review and Meta-Analysis. PLoS One. 2016 6;11(7): e0158765.
2. Jager KJ, Lindholm B, Goldsmith D, for European Renal and Cardiovascular Medicine working group of the European Renal Association–European Dialysis and Transplant Association (ERA–EDTA). Cardiovascular and non-cardiovascular mortality indialysis patients: Where is the link? Kidney Int Supl 2011;1(1):S21–3.
3. Tazza L, Di Napoli A, Bossola M, Valle S, Pezzotti P, Luciani G, et al. Ageing of patients on chronic dialysis: Effects on mortality: A 12-year study. Nephrol Dial Transplant. 2009;24(3):940–7.
4. Fried LF, Lee JS, Shlipak M, Chertow GM, Green C, Ding J, et al. Chronic Kidney Disease and Functional Limitation in Older People: Health, Aging and Body Composition Study. J Am Geriatr Soc. 2006; 54:750–6.
5. Sánchez-Tocino ML, Miranda-Serrano B, Gracia-Iguacel C, de-Alba-Peñaranda AM, Mas-Fontao S, López-González A, et al. Sarcopenia assessed by 4-step EWGSOP2 in elderly hemodialysis patients: Feasibility and limitations. PLoS One. 2022;17(1): e0261459.
6. Bowling CB, Sawyer P, Campbell RC, Ahmed A, Allman RM. Impact of chronic kidney disease on activities of daily living in community-dwelling older adults. J Gerontol A Biol Sci Med Sci. 2011;66:689-94.
7. Sánchez-Tocino ML, González-Parra E, Miranda-Serrano B, Gracia-Iguacel C, de-Alba-Peñaranda AM, López-González A, et al. Evaluation of the impact of an intradialytic exercise program on sarcopenia in very elderly hemodialysis patients, Clinical Kidney Journal. [Internet]. 2022; [consultado 15 Ene 2022]; sfac046. Disponible en: https://doi.org/10.1093/ckj/sfac046.
8. Moure L, Puialto MJ, Antolín R. Cambios nutricionales en el proceso de envejecimiento. Enfermería global. 2003;2:1-16.
9. Ikizler TA, Flakoll PJ, Parker RA, Hakim RM. Amino acid and albumin losses during hemodialysis. Kidney Int 1994; 46:830–7.
10. Jassal SV, Karaboyas A, Comment LA, Bieber BA, Morgenstern H, Sen A, et al. Functional Dependence and Mortality in the International Dialysis Outcomes and Practice Patterns Study (DOPPS) Am J Kidney Dis. 2016;67:283–92.
11. Jassal SV, Chiu E, Hladunewich M. Loss of independence in patients starting dialysis at 80 years of age or older. New Engl J Med. 2009;361:1612–3.
12. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J ChronicDis. 1987;40:373–83.
13. Hernández A, Pontes Y, Goñi I. Riesgo de malnutrición en una población mayor de 75 años no institucionalizada con autonomía funcional. Nutr. Hosp. [Internet]. 2015 [consultado 7 Oct 2021]; 32(3):1184-92. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S0212-16112015000900030&lng=es.
14. Rubio MA, Lou LM, Gimeno JA, Munguia P, Gutiérrez A, Lamban E, et al. Supervivencia y calidad de vida en pacientes ancianos en tratamiento renal conservador. Nefrología. 2019;39(2):141-50.
15. Gracia O, Lou L.M, Abad J.M, Álvarez R, Pérez J, García M, et al. Mortalidad durante el primer año y cumplimiento de los estándares de calidad de los pacientes incidentes en tratamiento renal sustitutivo en Aragón. Diálisis y Trasplante. 2017;38(1):57-63.
16. Kalantar-Zadeh K, Kopple JD, Block G, Humphreys MH: A malnutrition-inflammation score is correlated with morbidity and mortality in maintenance hemodialysis patients. Am J Kidney Dis. 2001;38(6):1251-63.
17. Wollinski FD, Callahan CM, Fitzgerald JF, Johnson RJ. Changes in functional status and the risks of subsequent nursing home placement and death. J Gerontol. 1993; 48(Supl 3):S94-101.
18. Shah S, Vanclay F, Cooper B. Improving the sensitivity of the Barthel Index for stroke rehabilitation. J ClinEpidemiol. 1989;42:703–9.
19. Morley JE, Vellas B, Van Kan GA, Anker DS, Bauer JM, Bernabei R, el al. Frailty consesus: a call to action. J Am Mad Dir Assosc. 2013;14(6):392-7.
20. González E. Composición Corporal; valoración y valor clínico. Endocrino Nutr. 2013;60(2):69-75.
21. Pérez-García R, Jaldo M, Alcázar R, de Sequera P, Albalate M, Puerta M, et al. El Kt/V alto, a diferencia del Kt, se asocia a mayor mortalidad: importancia de la V baja. Nefrología. 2019;39(1):58-66.
22. Kurella M, Covinsky KE, Chertow GM, Yaffe K, Landefeld CS, McCulloch CE. Functional status of elderly adults before and after initiation of dialysis. N Engl J Med. 2009; 361(16):1539-47.
23. Ikizler TA, Pupim LB, Brouillette JR, Levenhagen DK, Farmer K, Hakim RM, et al. Hemodialysis stimulates muscle and whole body protein loss and alters substrate oxidation. Am J Physiol Endocrinol Metab. 2002; 282: E107.
24. Ikizler TA, Flakoll PJ, Parker RA, Hakim RM. Amino acid and albumin losses during hemodialysis. Kidney Int. 1994;46(3):830-7.
25. Gelder BM, Tijhuis MA, Kalmijn S, Giampaoli S, Nissinen A, Kromhout D. Physical activity in relation to cognitive decline in elderly men: the FINE study. Neurology. 2004; 63(12):2316-21.
26. Saka B, Kaya O, Ozturk GB, Erten N, Karan MA. Malnutrition in the elderly and its relationship with other geriatric síndromes. Clin Nutr. 2010;29(6):745-8.
27. Lowrie EG, Lew NL. Commonly measured laboratory variables in hemodialysis patients: relationships among them and to death risk. Semin Nephrol. 1992; 12(3):276-83.
28. García-Cantón C, Ródenas A, López C, Rivero Y, Díaz N, Antón G, et al. Frailty prevalence and associated factors in hemodialysis patients. Nefrologia (Engl Ed). 2019; 39(2):204-6.
29. Kang SH, Do JY, Lee SY, Kim JC. Effect of dialysis modality on frailty phenotype, disability, and health-related quality of life in maintenance dialysis patients. PLoS One. 2017; 12(5): e0176814.
30. Rubio M, San Juan A, Gutierrez A, Mercadal E, Blasco A, Navarro PM, et al. Fragilidad en pacientes con Enfermedad renal crónica avanzada en tratamiento renal conservador. Diálisis y Trasplante. 2017;38:92-9.
31. Ollero M, Cabrera JM, de Osorno M, de Villar E, García D, Gómez E, et al. Atención al paciente pluripatológico: Proceso asistencial integrado. Sevilla: Consejería de Salud; 2007 (3ª edición).
32. Thong MS, Kaptein AA, Krediet RT, Boeschoten EW, Dekker FW. Social support predicts survival in dialysis patients. Nephrol Dial Transplant. 2007;22(3):845-50.
33. Lin YT, Wu PH, Kuo MC, Lin MY, Lee TC, Chiu YW, et al. High cost and low survival rate in high comorbidity incident elderly hemodialysis patients. PLoS One. 2013; 8(9): e75318.
35. Sclauzero P, Galli G, Barbati G, Carraro M, Panzetta GO. Role of components of frailty on quality of life in dialysis patients: a cross-sectional study. J Ren Care. 2013; 39(2):96-102.
36. Torres B, Núñez E, de Guzmán D, Simón JP, Alastuey C, Melián JD, et al. Índice de Charlson versus índice de Barthel como predictor de mortalidad e institucionalización en una unidad geriátrica de agudos y media estancia. Revista Española de Geriatría y Gerontología. 2009; 44(4):209-12.
Este artículo se distribuye bajo una Licencia Creative Commons Atribución–NoComercial 4.0 Internacional.
https://creativecommons.org/licenses/by-nc/4.0/
